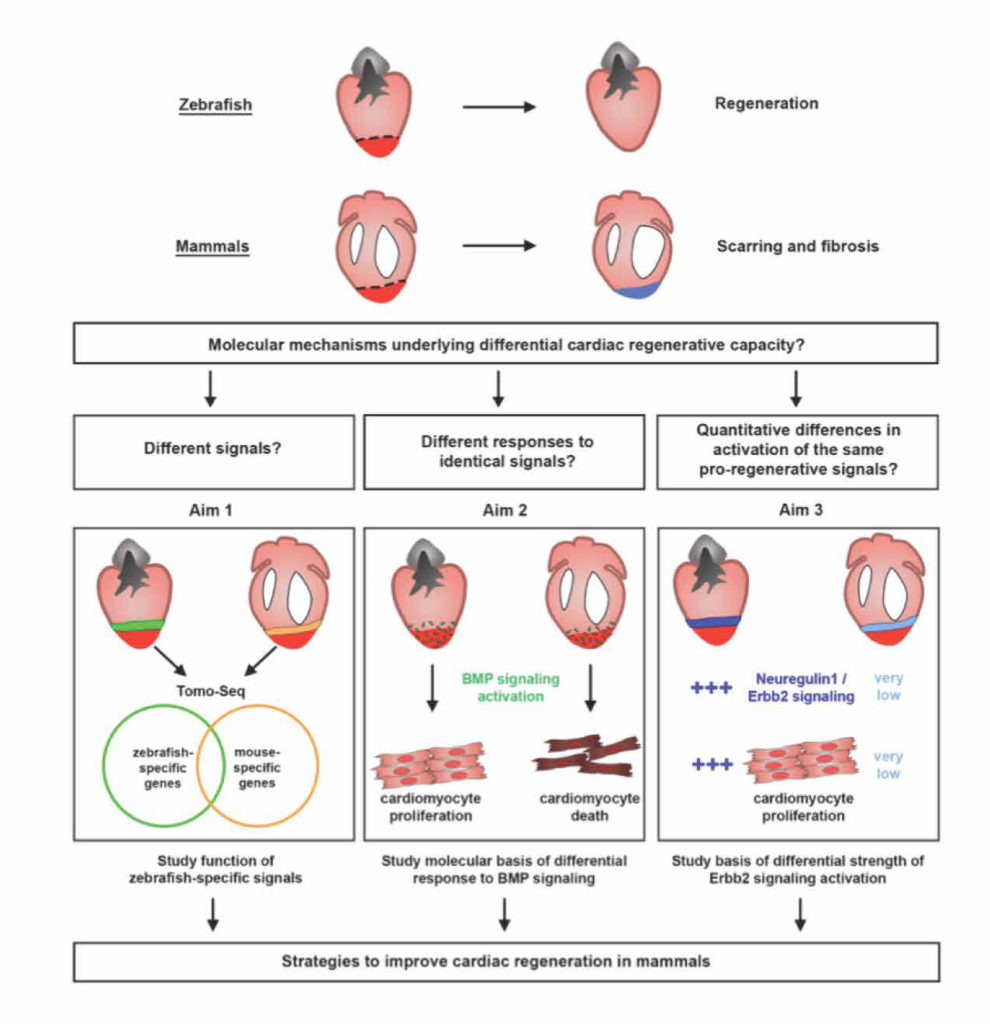
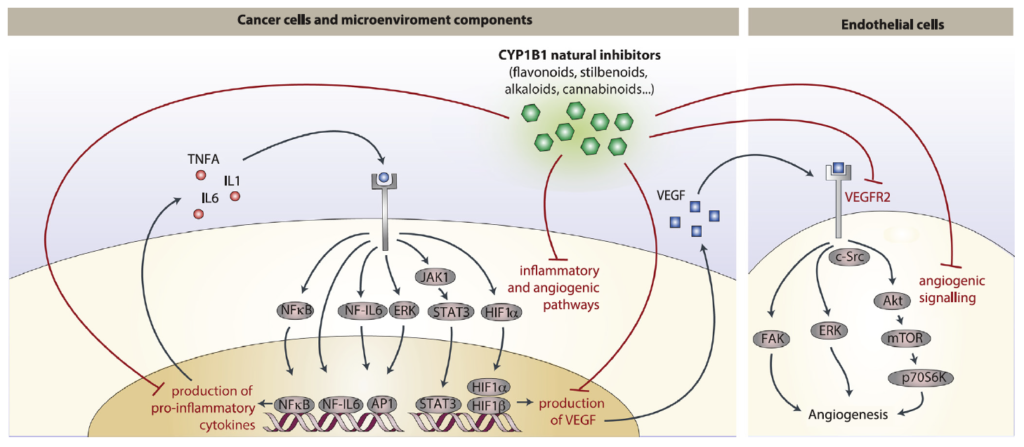
 Sommario: La chemioprevenzione del cancro è una strategia basata sull’uso di agenti sintetici, naturali o biologici per prevenire o ritardare lo sviluppo o la progressione dei tumori maligni. Abbiamo notato che molte sostanze fitochimiche (ovvero naturalmente presente in alcune piante) dotate di effetti anti-infiammatori e anti-angiogenici e recentemente proposte come strategie di chemioprevenzione, sono inibitori della famiglia 1B1 del citocromo P450 (CYP1B1), un enzima sovraespresso in un’ampia varietà di tumori e associato ad angiogenesi (ovvero lo sviluppo di nuovi vasi che possono aiutare a disseminare le cellule tumorali). A loro volta, varie citochine infiammatorie possono aumentare l’espressione di CYP1B1, suggerendo un ruolo chiave di CYP1B1 in un ciclo positivo di angiogenesi infiammatoria. Altre attività pro-tumorigeniche ben note di CYP1B1 si basano sulla bioattivazione di xenobiotici e ormoni steroidei nei loro derivati cancerogeni. Contrariamente ad osservazioni iniziali in vitro, studi in vivo hanno dimostrato un ruolo protettivo contro il cancro per gli altri membri della famiglia CYP1 (CYP1A1 e CYP1A2), suggerendo che la specificità degli inibitori della famiglia CYP1 deve essere attentamente considerata per lo sviluppo di potenziali strategie di chemioprevenzione. Studi recenti hanno anche proposto un ruolo di CYP1B1 in diversi tipi di cellule presenti nel microambiente tumorale, compresi fibroblasti, cellule endoteliali e globuli del sistema immunitario. Nel complesso, la nostro studio della letteratura attuale suggerisce un ciclo positivo tra citochine infiammatorie e CYP1B1, che a sua volta può giocare un ruolo chiave nell’angiogenesi del cancro, agendo sia su cellule tumorali che sul microambiente. Strategie che mirano all’inibizione specifica di CYP1B1 in più tipi di cellule possono tradursi in un approccio clinico alla chemioprevenzione e angioprevenzione.
Sommario: La chemioprevenzione del cancro è una strategia basata sull’uso di agenti sintetici, naturali o biologici per prevenire o ritardare lo sviluppo o la progressione dei tumori maligni. Abbiamo notato che molte sostanze fitochimiche (ovvero naturalmente presente in alcune piante) dotate di effetti anti-infiammatori e anti-angiogenici e recentemente proposte come strategie di chemioprevenzione, sono inibitori della famiglia 1B1 del citocromo P450 (CYP1B1), un enzima sovraespresso in un’ampia varietà di tumori e associato ad angiogenesi (ovvero lo sviluppo di nuovi vasi che possono aiutare a disseminare le cellule tumorali). A loro volta, varie citochine infiammatorie possono aumentare l’espressione di CYP1B1, suggerendo un ruolo chiave di CYP1B1 in un ciclo positivo di angiogenesi infiammatoria. Altre attività pro-tumorigeniche ben note di CYP1B1 si basano sulla bioattivazione di xenobiotici e ormoni steroidei nei loro derivati cancerogeni. Contrariamente ad osservazioni iniziali in vitro, studi in vivo hanno dimostrato un ruolo protettivo contro il cancro per gli altri membri della famiglia CYP1 (CYP1A1 e CYP1A2), suggerendo che la specificità degli inibitori della famiglia CYP1 deve essere attentamente considerata per lo sviluppo di potenziali strategie di chemioprevenzione. Studi recenti hanno anche proposto un ruolo di CYP1B1 in diversi tipi di cellule presenti nel microambiente tumorale, compresi fibroblasti, cellule endoteliali e globuli del sistema immunitario. Nel complesso, la nostro studio della letteratura attuale suggerisce un ciclo positivo tra citochine infiammatorie e CYP1B1, che a sua volta può giocare un ruolo chiave nell’angiogenesi del cancro, agendo sia su cellule tumorali che sul microambiente. Strategie che mirano all’inibizione specifica di CYP1B1 in più tipi di cellule possono tradursi in un approccio clinico alla chemioprevenzione e angioprevenzione.
In evidenza:
• CYP1B1 innesca la carcinogenesi attivando molecole esogene ed endogene a specie reattive.
• Altri membri della famiglia CYP1 giocano ruoli protettivi contro la formazione del tumore disintossicando da composti carcinogeni.
• CYP1B1 regola più tipi di cellule all’interno del microambiente cancerogeno, supportando un ciclo di angiogenesi infiammatoria.
• Diversi fitochimici chemiopreventivi sono potenti e specifici inibitori di CYP1B1.
• L’inibizione specifica di CYP1B1 potrebbe tradursi in approcci clinici di chemioprevenzione/angioprevenzione.
Vai all’articolo intero (in inglese): D’Uva G, Baci D, Albini A and Noonan DM. Cancer chemoprevention revisited: Cytochrome P450 family 1B1 as a target in the tumor and the microenvironment. Cancer Treatment Reviews, 2017

 Sommario: La chemioprevenzione del cancro è una strategia basata sull’uso di agenti sintetici, naturali o biologici per prevenire o ritardare lo sviluppo o la progressione dei tumori maligni. Abbiamo notato che molte sostanze fitochimiche (ovvero naturalmente presente in alcune piante) dotate di effetti anti-infiammatori e anti-angiogenici e recentemente proposte come strategie di chemioprevenzione, sono inibitori della famiglia 1B1 del citocromo P450 (CYP1B1), un enzima sovraespresso in un’ampia varietà di tumori e associato ad angiogenesi (ovvero lo sviluppo di nuovi vasi che possono aiutare a disseminare le cellule tumorali). A loro volta, varie citochine infiammatorie possono aumentare l’espressione di CYP1B1, suggerendo un ruolo chiave di CYP1B1 in un ciclo positivo di angiogenesi infiammatoria. Altre attività pro-tumorigeniche ben note di CYP1B1 si basano sulla bioattivazione di xenobiotici e ormoni steroidei nei loro derivati cancerogeni. Contrariamente ad osservazioni iniziali in vitro, studi in vivo hanno dimostrato un ruolo protettivo contro il cancro per gli altri membri della famiglia CYP1 (CYP1A1 e CYP1A2), suggerendo che la specificità degli inibitori della famiglia CYP1 deve essere attentamente considerata per lo sviluppo di potenziali strategie di chemioprevenzione. Studi recenti hanno anche proposto un ruolo di CYP1B1 in diversi tipi di cellule presenti nel microambiente tumorale, compresi fibroblasti, cellule endoteliali e globuli del sistema immunitario. Nel complesso, la nostro studio della letteratura attuale suggerisce un ciclo positivo tra citochine infiammatorie e CYP1B1, che a sua volta può giocare un ruolo chiave nell’angiogenesi del cancro, agendo sia su cellule tumorali che sul microambiente. Strategie che mirano all’inibizione specifica di CYP1B1 in più tipi di cellule possono tradursi in un approccio clinico alla chemioprevenzione e angioprevenzione.
Sommario: La chemioprevenzione del cancro è una strategia basata sull’uso di agenti sintetici, naturali o biologici per prevenire o ritardare lo sviluppo o la progressione dei tumori maligni. Abbiamo notato che molte sostanze fitochimiche (ovvero naturalmente presente in alcune piante) dotate di effetti anti-infiammatori e anti-angiogenici e recentemente proposte come strategie di chemioprevenzione, sono inibitori della famiglia 1B1 del citocromo P450 (CYP1B1), un enzima sovraespresso in un’ampia varietà di tumori e associato ad angiogenesi (ovvero lo sviluppo di nuovi vasi che possono aiutare a disseminare le cellule tumorali). A loro volta, varie citochine infiammatorie possono aumentare l’espressione di CYP1B1, suggerendo un ruolo chiave di CYP1B1 in un ciclo positivo di angiogenesi infiammatoria. Altre attività pro-tumorigeniche ben note di CYP1B1 si basano sulla bioattivazione di xenobiotici e ormoni steroidei nei loro derivati cancerogeni. Contrariamente ad osservazioni iniziali in vitro, studi in vivo hanno dimostrato un ruolo protettivo contro il cancro per gli altri membri della famiglia CYP1 (CYP1A1 e CYP1A2), suggerendo che la specificità degli inibitori della famiglia CYP1 deve essere attentamente considerata per lo sviluppo di potenziali strategie di chemioprevenzione. Studi recenti hanno anche proposto un ruolo di CYP1B1 in diversi tipi di cellule presenti nel microambiente tumorale, compresi fibroblasti, cellule endoteliali e globuli del sistema immunitario. Nel complesso, la nostro studio della letteratura attuale suggerisce un ciclo positivo tra citochine infiammatorie e CYP1B1, che a sua volta può giocare un ruolo chiave nell’angiogenesi del cancro, agendo sia su cellule tumorali che sul microambiente. Strategie che mirano all’inibizione specifica di CYP1B1 in più tipi di cellule possono tradursi in un approccio clinico alla chemioprevenzione e angioprevenzione.