Le malattie cardiache ischemiche e i tumori sono le principali cause di morte in tutto il mondo. Da una parte, le cellule tumorali vanno incontro ad una proliferazione deregolata. Al contrario, l’incapacità delle cellule muscolari cardiaci (cardiomiociti) di rientrare nel ciclo cellulare e proliferare è una delle ragioni principali della mancanza di capacità rigenerativa cardiaca nei mammiferi adulti.
Il nostro laboratorio mira a comprendere i meccanismi molecolari alla base del differenziamento e proliferazione cellulare in queste due patologie per sviluppare nuove strategie per “bloccare” più efficacemente le cellule tumorali e per “sbloccare” il potenziale rigenerativo cardiaco.
Inoltre stiamo studiando contemporaneamente la crescita tumorale e la funzione cardiaca, allo scopo di sviluppare strategie terapeutiche innovative per l’emergente problema della cardiotossicità delle terapie antitumorali, responsabile di una bassa qualità della vita e ridotta sopravvivenza di pazienti affetti da tumore, indipendentemente dalla prognosi oncologica.
Rigenerazione cardiaca
Lesioni cardiache severe, come quelle indotte da infarto miocardico (noto anche come attacco di cuore), portano ad una significativa perdita di cellule muscolari cardiache (cardiomiociti), sostituite da tessuto fibrotico non contrattile (una vera e propria cicatrice) nel sito dell’infarto. La perdita di cellule contrattili e l’incapacità del cuore di mammiferi adulti di rigenerarsi è una causa principale di disfunzione e insufficienza cardiaca.
La stimolazione della proliferazione dei cardiomiociti endogeni sopravvissuti all’infarto è una strategia promettente per la rigenerazione funzionale del cuore in pazienti con insufficienza cardiaca. È quindi necessario comprendere meglio le vie di segnalazione molecolari che promuovono la proliferazione dei cardiomiociti.
In precedenza abbiamo descritto importanti meccanismi molecolari che regolano il rinnovamento / rigenerazione di diversi tessuti (Nature Cell Biology, 2015; Cell Cycle, 2015; Nature Immunology 2012; Nature Immunology 2011; JCI; 2013, Leukemia, 2013). Nel tessuto cardiaco abbiamo recentemente dimostrato che il co-recettore ERBB2 è necessario per la risposta proliferativa indotta dal fattore di crescita Neuregulin 1 (NRG1) durante lo stadio embrionale e neonatale. Inoltre abbiamo scoperto che i livelli cardiaci di ERBB2 diminuiscono subito dopo la nascita nei topi, come parte del meccanismo che porta al differenziamento terminale e uscita dal ciclo cellulare dei cardiomiociti e, conseguentemente, alla perdita di capacità rigenerativa del cuore. Tramite l’utilizzo di modelli trasgenici, abbiamo dimostrato che l’induzione transiente della segnalazione indotta da ERBB2 è sufficiente a promuovere un massiccio dedifferenziamento e proliferazione dei cardiomiociti e una robusta risposta rigenerativa a seguito di infarto miocardico in topi adulti (Nature Cell Biology, 2015; Cell Cycle, 2015).
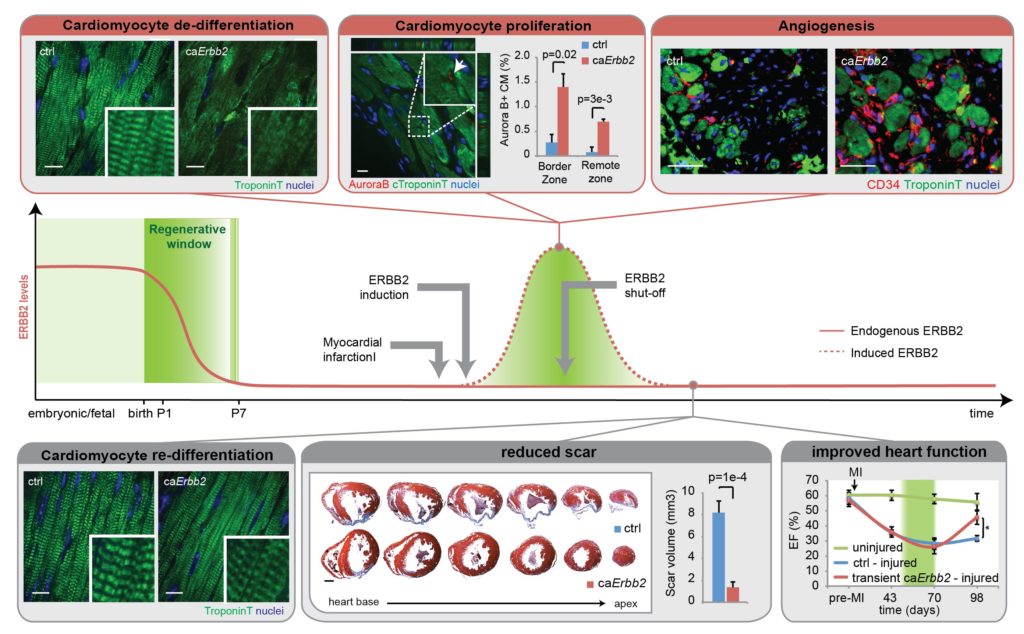 Attualmente stiamo esplorando strategie di modulazione della segnalazione indotta da ERBB2, allo scopo di sviluppare nuovi approcci di medicina rigenerativa per il cuore dei mammiferi adulti basati sul rinnovo dei cardiomiociti endogeni.
Attualmente stiamo esplorando strategie di modulazione della segnalazione indotta da ERBB2, allo scopo di sviluppare nuovi approcci di medicina rigenerativa per il cuore dei mammiferi adulti basati sul rinnovo dei cardiomiociti endogeni.
Rigraziamo il programma ERA-NET dell’Unione Europea, Fondazione Fanti Melloni e Fondazione Carisbo per il supporto a questo progetto di ricerca.
Cancro & Cardiotossicità
La biologia delle cellule tumorali ha svolto un ruolo cruciale nel chiarire i meccanismi molecolari attraverso i quali le vie di segnalazione cellulare oncogeniche sostengono comportamenti maligni e nell’identificare bersagli terapeutici per farmaci anti-tumorali. Tra questi, i recettori dei fattori di crescita della famiglia ERBB (composti da EGFR / ERBB1, ERBB2, ERBB3 e ERBB4) svolgono un ruolo importante in una varietà di tipi di carcinomi. ERBB2 (noto anche come HER2) è l’unico membro della famiglia di recettori ERBB incapace di legare i ligandi. Tuttavia è il partner preferenziale per l’eterodimerizzazione, potenziando e diversificando notevolmente le vie di segnalazione a valle. ERBB2 è sovraespresso in circa il 25-30% dei carcinomi mammari e in molti altri tipi di cancro. Questi ultimi decenni hanno visto notevoli progressi nella comprensione del ruolo guida del gene ERBB2 nella sopravvivenza, proliferazione, migrazione e resistenza alle chemioterapie delle cellule tumorali. L’inibizione farmacologica di ERBB2, tramite anticorpi monoclonali o inibitori tirosino-chinasici, rappresenta una pietra miliare nel trattamento del cancro. Purtroppo la cardiotossicità è un grave effetto collaterale delle terapie anti-HER2.
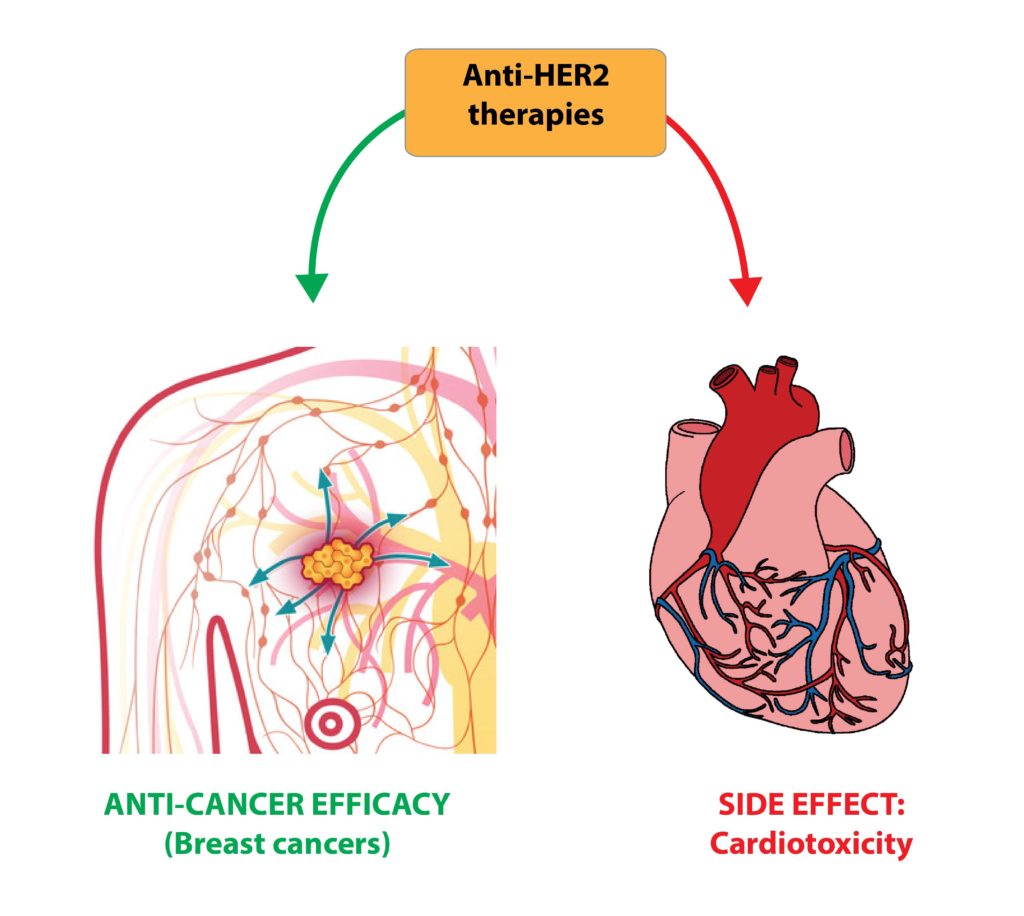
In precedenza abbiamo contribuito a chiarire il ruolo, il signalling e le interazioni dei recettori ERBB in tumori solidi (Nature Communication, 2014; Oncotarget 2016; Seminars in Cell and Developmental Biology, 2016; Plos One, 2013) così come nel cuore (Nature Cell Biology, 2015; Cell Cycle, 2015). Chiarendo i dettagli molecolari dell’asse ligando-recettore NRGs-ERBB in carcinomi mammari e in tessuti cardiaci, ci proponiamo di migliorare l’efficacia e la sicurezza delle terapie anticancro basate sul blocco di HER2.
Ringraziamo AIRC e Fondazione Cariplo per il supporto a questo progetto di ricerca.