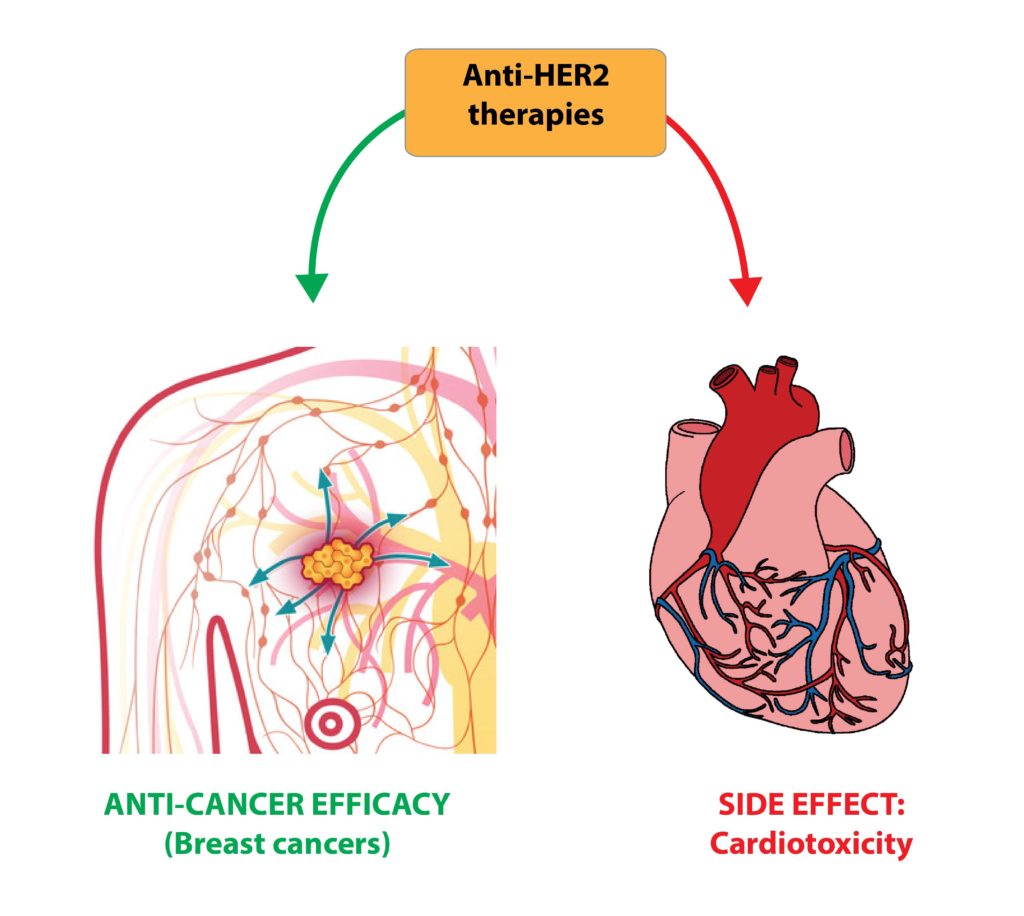
Alcuni farmaci antitumorali possono purtroppo indurre effetti collaterali sul cuore. Questo fenomeno, chiamato cardiotossicità, nei casi gravi può ridurre la qualità ed aspettativa di vita di pazienti malati di cancro, indipendentemente dal quadro clinico oncologico.
La buona notizia è che i complessi meccanismi molecolari responsabili di questi effetti in classi differenti di farmaci antitumorali stanno cominciando ad emergere, e grazie a ciò cominciano ad essere proposti potenziali approcci terapeutici per proteggere il cuore da questi effetti.
#cardiotossicità #farmaciantitumorali #ricercascientifica #medicina #salute #unibo #irccsmultimedica #conFondazioneCariplo

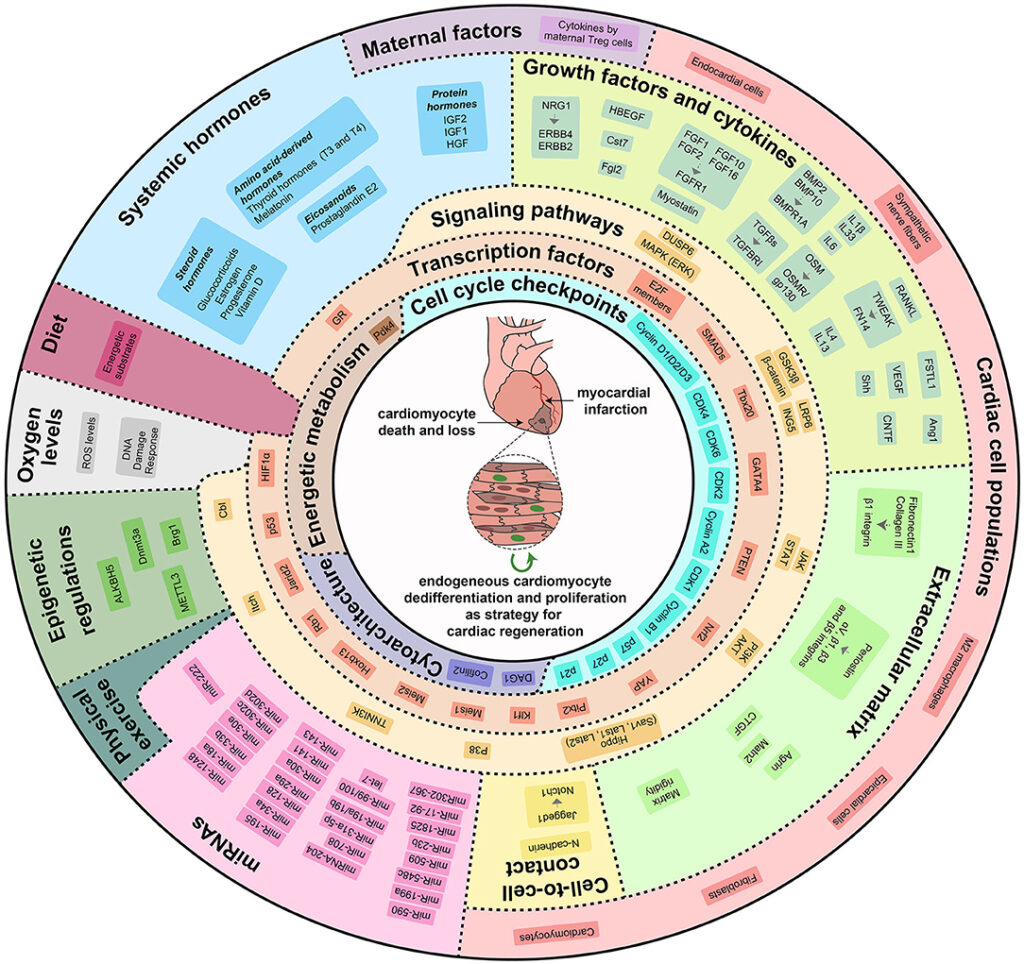
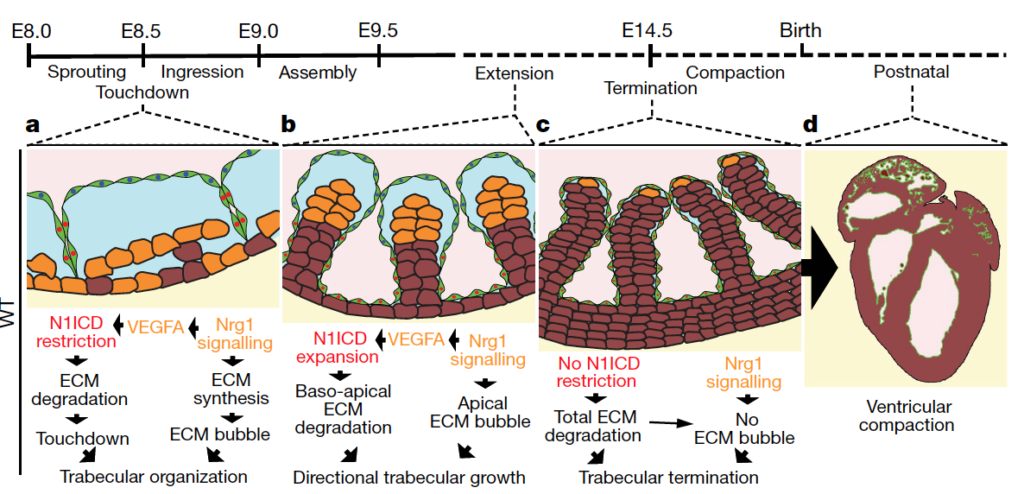
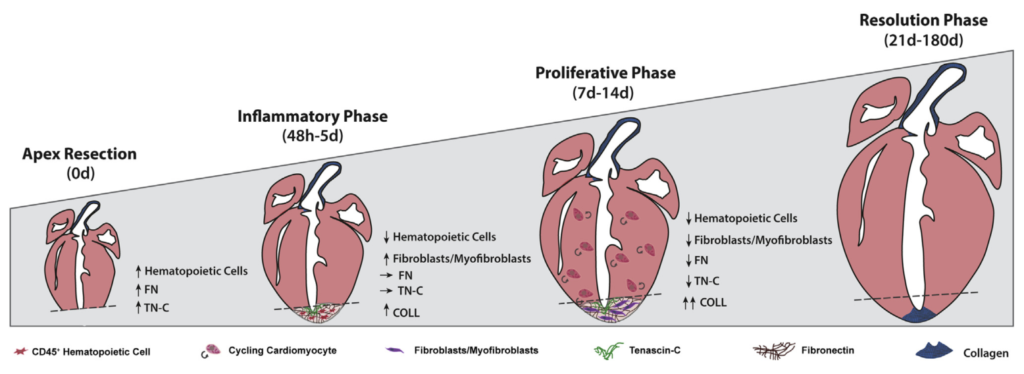
Abstract: Chemotherapy and targeted therapies have significantly improved the prognosis of oncology patients. However, these antineoplastic treatments may also induce adverse cardiovascular effects, which may lead to acute or delayed onset of cardiac dysfunction. These common cardiovascular complications, commonly referred to as cardiotoxicity, not only may require the modification, suspension, or withdrawal of life-saving antineoplastic therapies, with the risk of reducing their efficacy, but can also strongly impact the quality of life and overall survival, regardless of the oncological prognosis. The onset of cardiotoxicity may depend on the class, dose, route, and duration of administration of anticancer drugs, as well as on individual risk factors. Importantly, the cardiotoxic side effects may be reversible, if cardiac function is restored upon discontinuation of the therapy, or irreversible, characterized by injury and loss of cardiac muscle cells. Subclinical myocardial dysfunction induced by anticancer therapies may also subsequently evolve in symptomatic congestive heart failure. Hence, there is an urgent need for cardioprotective therapies to reduce the clinical and subclinical cardiotoxicity onset and progression and to limit the acute or chronic manifestation of cardiac damages. In this review, we summarize the knowledge regarding the cellular and molecular mechanisms contributing to the onset of cardiotoxicity associated with common classes of chemotherapy and targeted therapy drugs. Furthermore, we describe and discuss current and potential strategies to cope with the cardiotoxic side effects as well as cardioprotective preventive approaches that may be useful to flank anticancer therapies.
Vai all’articolo originale (in inglese): Morelli MB, Miano C, Bongiovanni C, Sacchi F, Da Pra S, Lauriola M and D’Uva G. Cardiotoxicity of Anticancer Drugs: Molecular Mechanisms and Strategies for Cardioprotection. Frontiers in Cardiovascular Medicine, 2022
 I tumori al seno denominati “triplo negativo” e “basal-like” sono sottotipi di carcinoma mammario particolarmente aggressivi e con meno opzioni terapeutiche.
I tumori al seno denominati “triplo negativo” e “basal-like” sono sottotipi di carcinoma mammario particolarmente aggressivi e con meno opzioni terapeutiche.