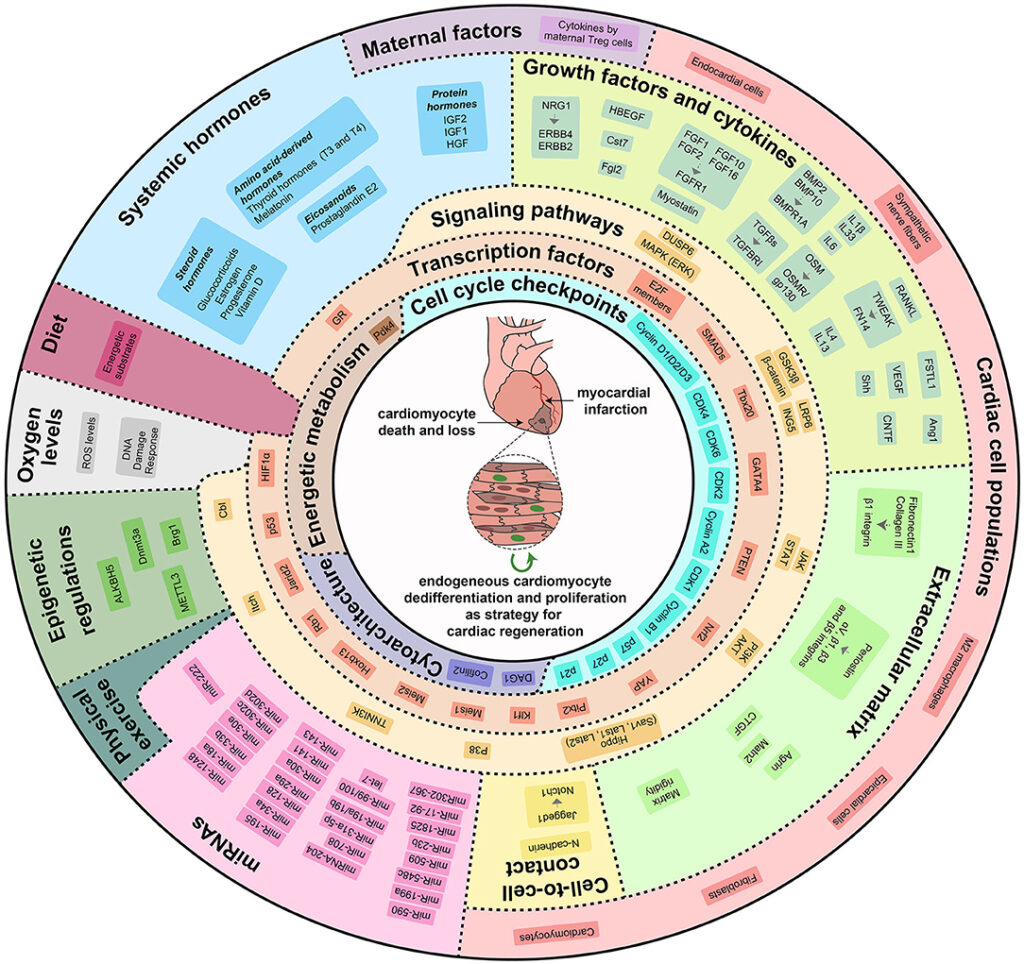
Siamo entusiasti di annunciare la nostra nuova pubblicazione su Nature Cardiovascular Research, in cui descriviamo una strategia innovativa per potenziare la rigenerazione del cuore attraverso il blocco del recettore dei glucocorticoidi.
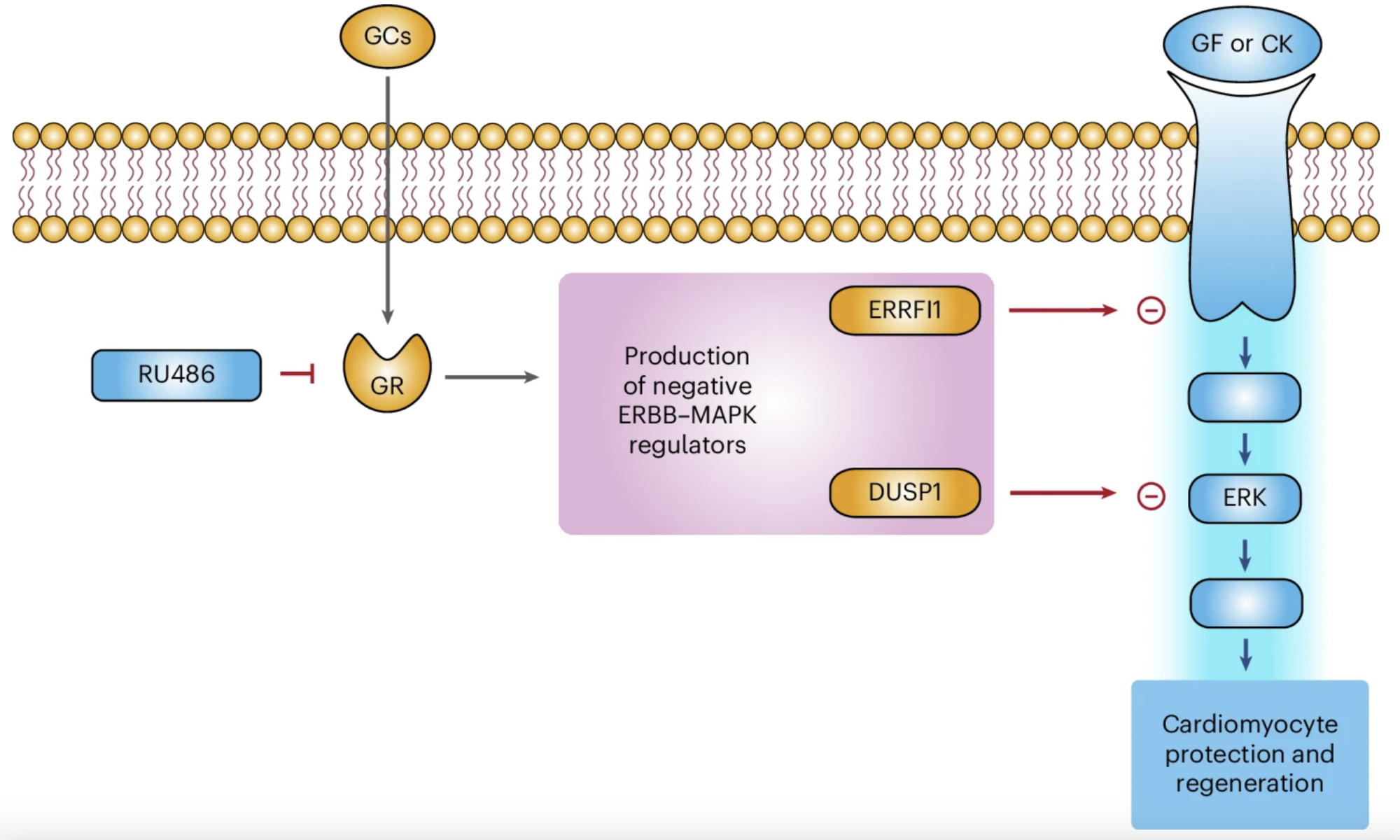
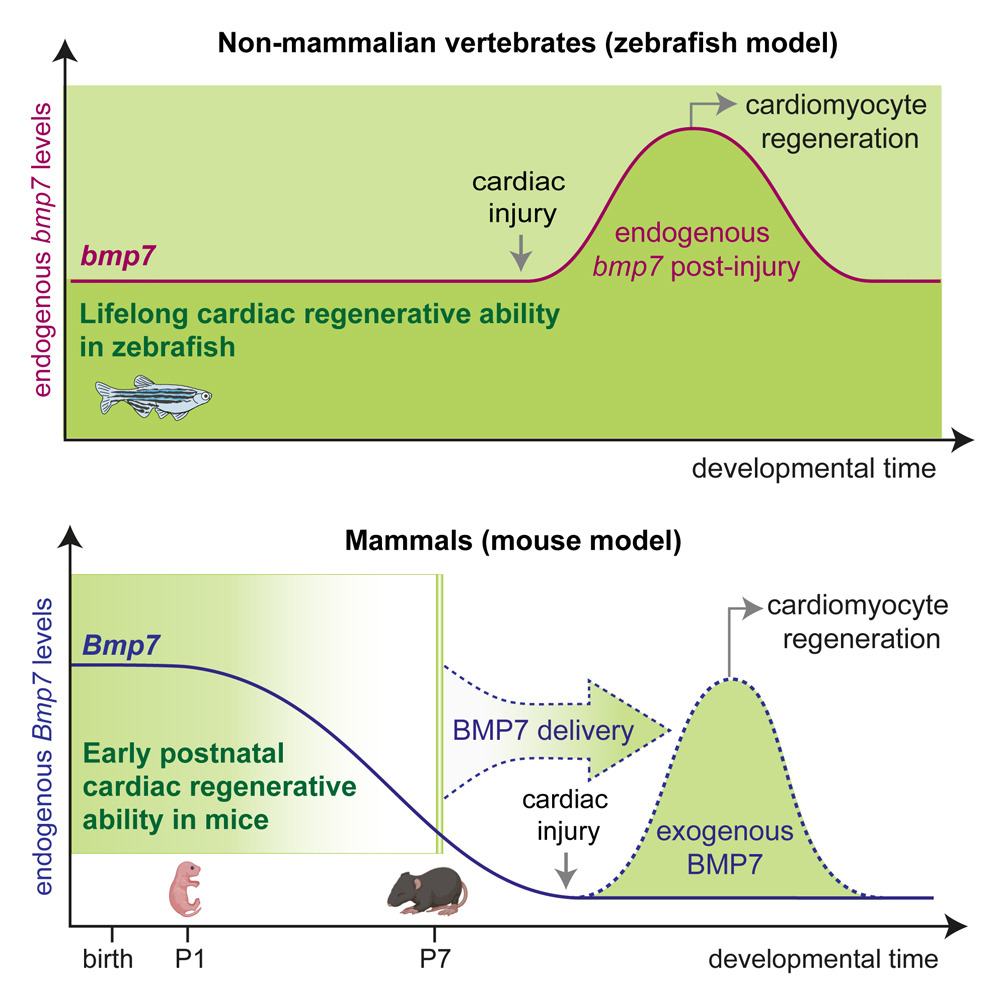
Nel nostro studio dimostriamo che i glucocorticoidi, ormoni steroidei fisiologicamente presenti in circolo, svolgono un ruolo chiave nel limitare la risposta dei cardiomiociti ai principali fattori di crescita e citochine rigenerative. In particolare, mostriamo che questi ormoni agiscono come un vero e proprio freno ormonale, contribuendo alla perdita della capacità rigenerativa del cuore nelle fasi postnatali avanzate e nell’età adulta.
Un risultato centrale del nostro lavoro è la dimostrazione che il blocco farmacologico del recettore dei glucocorticoidi è in grado di rimuovere questo freno, ripristinando la capacità dei cardiomiociti di rispondere agli stimoli proliferativi. Questo approccio consente di potenziare in modo sostanziale l’efficacia delle terapie rigenerative basate su fattori di crescita, anche in cuori maturi.
Nei modelli preclinici, abbiamo inoltre osservato che la combinazione tra un antagonista del recettore dei glucocorticoidi e un fattore rigenerativo produce risultati nettamente superiori rispetto ai singoli trattamenti. Questo effetto risulta particolarmente rilevante anche in contesti di danno cardiaco associato a terapie oncologiche con antracicline, dove l’approccio combinato ha migliorato la sopravvivenza dei cardiomiociti e preservato la funzione cardiaca.
Nel complesso, riteniamo che questi risultati aprano nuove prospettive per lo sviluppo di approcci terapeutici combinati mirati alla rigenerazione del tessuto cardiaco e che, se validati clinicamente, potrebbero avere un impatto significativo nel trattamento dell’insufficienza cardiaca.
Congratulazioni a Silvia Da Pra e Stefano Boriati, ricercatrice post-dottorato e dottorando del nostro gruppo, che hanno svolto la maggior parte delle attività sperimentali, e grazie a tutti i membri del team Carmen Miano, Francesca Sacchi, Chiara Bongiovanni, Irene Del Bono and Nicola Pianca per il loro contributo. Ringraziamo inoltre i collaboratori che sono stati fondamentali per il successo di questo progetto, in particolare i gruppi di ricerca guidati da Eldad Tzahor (Weizmann Institute of Science, Israele), Catherine Wilson (Università di Cambridge, Regno Unito), Mattia Lauriola e Carlo Ventura (Università di Bologna, Italia).
Vai all’articolo completo: : Da Pra S, Boriati S, Miano M, Sacchi F, Batho C, Bongiovanni C, Del Bono I, Aharonov A, Pianca N, Tassinari R, Dahir R, Ventura C, Lauriola M, Tzahor E, Wilson C & D’Uva G. Harnessing glucocorticoid receptor antagonism to enhance the efficacy of cardiac regenerative growth factors and cytokines : Nature Cardiovascular Research 2026
Accesso in sola lettura all’articolo (nessun abbonamento richiesto): https://rdcu.be/e2EN0

 I tumori al seno denominati “triplo negativo” e “basal-like” sono sottotipi di carcinoma mammario particolarmente aggressivi e con meno opzioni terapeutiche.
I tumori al seno denominati “triplo negativo” e “basal-like” sono sottotipi di carcinoma mammario particolarmente aggressivi e con meno opzioni terapeutiche.